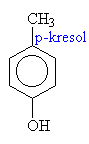Kyslíkaté deriváty uhlovodíků
Přehled
kyslík je v kyslíkatých derivátech uhlovodíků vždy v oxidačním čísle -II
|
|
|
|
-O-H |
hydroxyskupina |
|
C=O |
karbonyl (karbonylová skupina) |
|
-COOH |
karboxylová skupina |
|
R-O-H |
hydroxysloučeniny |
|
R-O-R |
ethery |
|
R-CHO |
aldehydy |
|
R-CO-R |
ketony |
|
R-COOH |
karboxylové kyseliny |
|
|
|
|
|
|
|
|
|
|
|
|
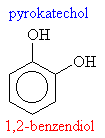
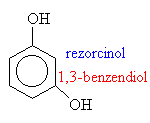
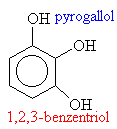
Hydroxysloučeniny
F obecný vzorec: R-OH
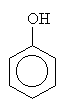
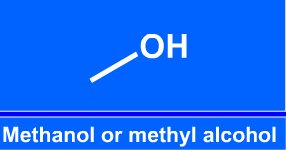
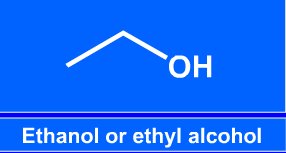
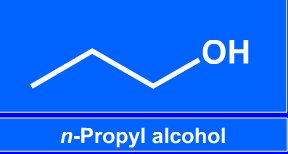
o alkoholy: R je alkyl (třeba methyl...)
o fenoly: R je aryl (třeba fenyl)
F rozdělení dle uhlíku, na kterém je vázána hydroxyskupina:
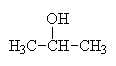
o alkoholy primární: R-OH
o
alkoholy terciální: 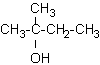
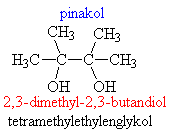
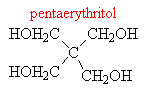
F rozdělení dle sytnosti (= dle počtu hydroxyskupin)
o jednosytné – obsahují 1x –OH skupinu
o vícesytné: 2x, 3x… -OH skupina
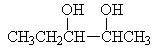
§ vícesytné odštěpují molekulu vody za vzniku ketonů
Příprava alkoholů
F Z přírodních látek: ethanol se připravuje kvašením cukrů
F Průmyslová výroba:
o z nenasycených uhlovodíků = adice vody na dvojnou vazbu (katalýza H2SO4 případně H3PO4):
CH2=CH2 +H2O -> CH3-CH2-OH
mechanismus:
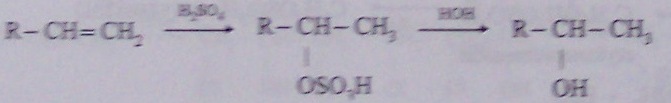
F adice vody na alkeny s delším řetězcem
o -> sekundární alkoholy:
CH3-CH=CH2 + H2O -> CH3-CHOH – CH3
o -> terciální alkoholy (je-li řetězec na dvojné vazbě větven)
o z halogenderivátů
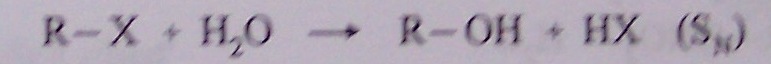
o z aldehydů

o z ketonů
o dvojsytné alkoholy:
§ oxidaci alkenů zředěným roztokem KMnO4
o oxidací alkenů
§ ethen + kyslík -> ethylenoxid
§ ethylenoxid + voda -> ethan – 1,2- diol (=ethylenglykol)
o hydrolýza halogenderivátů
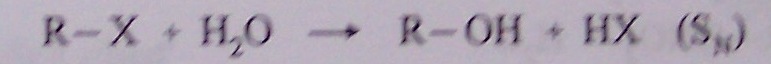
-
toluen + chlor -> benzyl chlorid
-
adicí Grignardových sloučenin na karbonylové sloučeniny
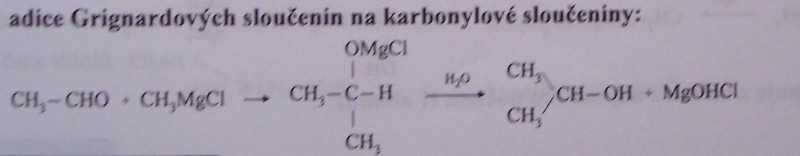
-
benzylchlorid + voda -> benzylalkohol
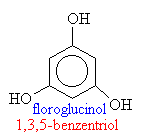
Příprava fenolů
F Přímo z aromatických uhlovodíků
1. Benzen + kyselina sírová -> benzensulfonová kyselina
2. benzensulfonová kyselina + hydroxid sodný -> benzensulfonan sodný
3.
benzensulfonan sodný + hydroxid sodný (tavba při 300
4. fenolát sodný + oxid uhličitý + voda -> fenol + hydrogenuhličitan sodný
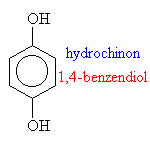
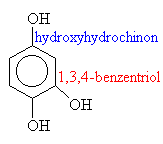
F Oxidací:
o Anilín + kyslík -> chinon
o Chinon + voda -> hydrochinon
Výroba glycerolu
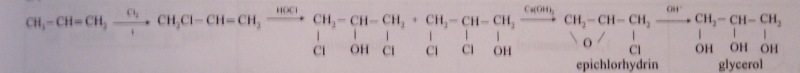
Názvosloví alkoholů
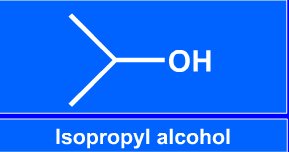
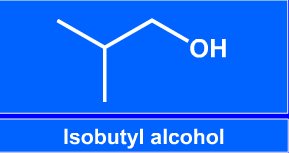
|
||
|
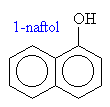
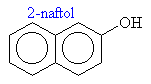
Názvosloví fenolů
Reakce alkoholů
Substituce nukleofilní
-OH je silné nukleofilní činidlo, je-li použito silné nukleofilní činidlo (= silná báze), dochází ke štěpení vazby -O- H
tvorba alkoholátů
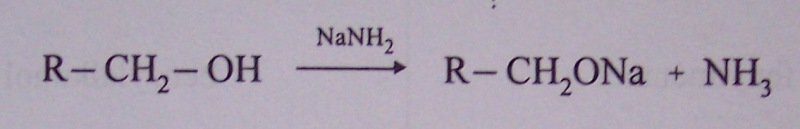
v kyselém prostředí
vznik halogenderivátu
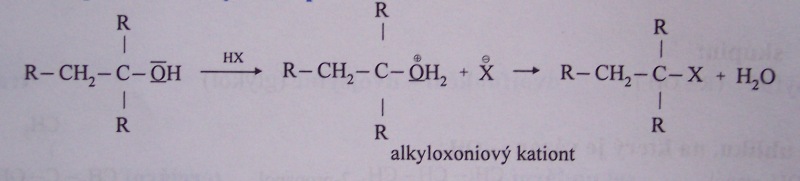
příklady nukleofilních substitucí
(s kyselinou sírovou, amoniakem a kyselinou dusičnou)
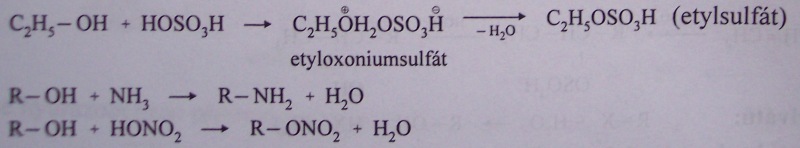
oxidace alkoholů
oxidace primárních a sekundárních alkoholů
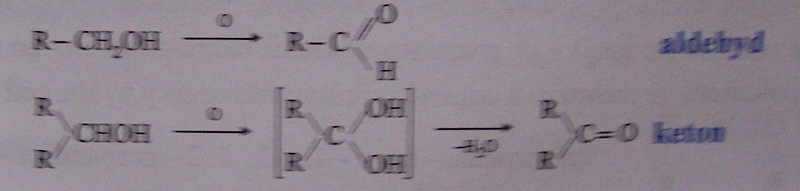
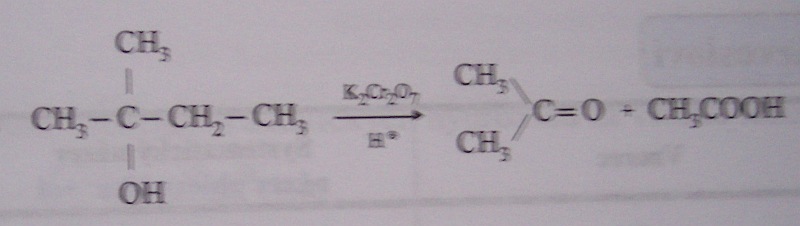
oxidace silnými oxidačními činidly
oxidace diolů
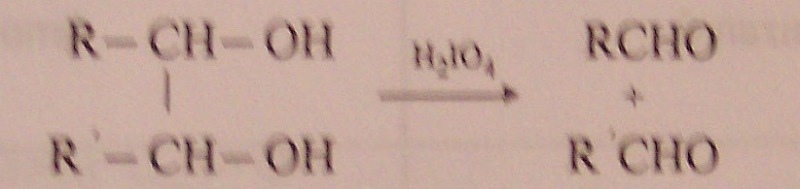
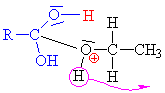
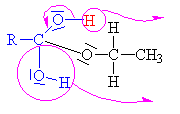
Esterifikace
(zdroj: http://www.jergym.hiedu.cz/~canovm/)
|
Esterifikace
je reakce alkoholu s kyselinou nebo s jejím derivátem |
||||||
|
Esterifikace
s anorganickou kyselinou
|
||||||
|
Esterifikace
s organickou kyselinou |
||||||
|
||||||
|
Porovnání
esterifikace s organickou kyselinou v kyselém a neutrálním prostředí (myšleno bez
použití minerální kyseliny) |
||||||
|
Esterifikace
alkoholu kyselinou sírovou
|
Schématický zápis: |
|||||||||||||||||||
|
|||||||||||||||||||
|
Podrobný zápis: |
|||||||||||||||||||
|
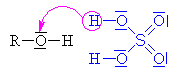
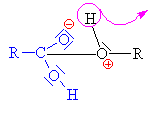
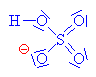
Kyselina sírová se chová jako kyselina a
alkohol jako zásada,
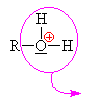
to znamená, že volný elektronový pár na kyslíku v alkoholu přijímá vodík a
vzniká alkyloxoniový kationt
(kyslík má pouze 5 elektronů a proto má náboj plus). Chybějící elektron
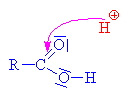
získává heterolytickým odštěpením od
uhlíku.Odštěpovaná voda je nahrazována mechanismem nukleofilní
substituce Sn (porovnej s halogenderiváty). Nukleofilním
činidlem je hydrogensulfát (zde je použit
mechanismus molekulární Sn1, mechanismus Sn2
ukázán dole
nebo zde
klikni). |
|||||||||||||||||||
|
|||||||||||||||||||
|
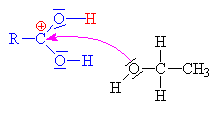
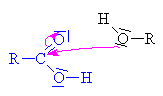
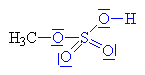
Vzniklý karbokation se spojuje s
hydrogensulfátovým aniontem
za vzniku anorganického esteru alkoholu a kyseliny sírové. |
|||||||||||||||||||
|
|||||||||||||||||||